Skupenské stavy vody – ľad, voda a para – sú asi každému dobre známe. Existuje však aj taká forma tejto najobyčajnejšej látky na Zemi, ktorú nemožno zaradiť k žiadnemu z nich. Aj napriek jej dlhodobému využívaniu ju dosiaľ takmer nik nevidel. Volá sa superkritická voda.
Objasnime si najprv význam slova voda. Tých významov je viacero, no s ohľadom na našu tému sú dôležité najmä dva. V prvom prípade sa ním označuje čistá látka, ktorej chemické zloženie vyjadruje známy vzorec H2O, v druhom prípade je to označenie kvapalného skupenstva tejto látky. V tomto článku sa používa predovšetkým v jeho prvom význame.
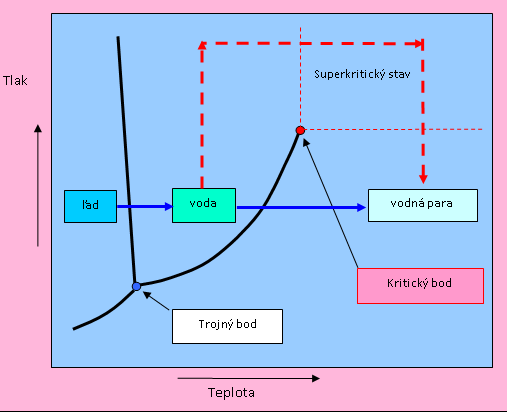
Fázový diagram
Fázový diagram vody hovorí o tom, pri akých teplotách a tlakoch môže existovať ľad, pri akých kvapalná voda a pri akých vodná para. Zároveň hovorí o tom, pri akých teplotách a tlakoch dochádza k premene jedného skupenstva na druhé. Ak predpokladáme,že východiskovým bodom bude teplota -20 °C a štandardný atmosférický tlak 0,1 MPa a ideme na diagrame zľava doprava (teda zvyšujeme teplotu), meníme najskôr ľad na vodu a neskôr vodu na vodnú paru. Táto premena platí pri všetkých tlakoch s výnimkou tých, ktoré sú pod takzvaným trojným bodom (pri teplote 0,01 °C a tlaku 611,7 Pa). Pod ním sa ľad premieňa sublimáciou priamo na vodnú paru. Druhou výnimkou sú teploty a tlaky nad kritickým bodom. Naša téma sa týka práve tohto prípadu.
Nezvyčajná forma vody
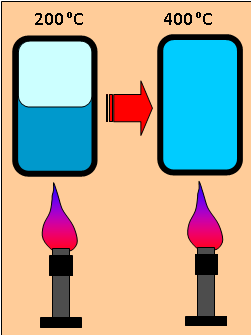
Na slovné spojenie superkritická voda si možno spomeniete v súvislosti so spomínaným fázovým diagramom vody z učebníc fyziky. Pri teplotách a tlakoch nad kritickým bodom opúšťa naša obyčajná voda svoju zvyčajnú podobu a stáva sa superkritickou. Podmienky, pri ktorých existuje, nám ju však nedovoľujú vidieť. Jej snímku by sme museli urobiť minimálne tesne nad teplotou 374,14 °C a tlaku 22,09 MPa – takéto podmienky možno dosiahnuť iba v hrubostennej kovovej nádobe. Superkritická voda je teda dosť záhadná forma vody, a preto si môžeme pomôcť bezpečnejším (hoci len abstraktným) experimentom. Predstavme si, že kvapalnú vodu máme v uzavretej priehľadnej hrubostennej nádobe a postupne ju ohrievame. Voda sa so zvyšujúcou teplotou odparuje, ale pretože jej pary nemajú kde uniknúť, tlak v nádobe sa postupne zvyšuje. Dosiahli sme už teplotu napríklad 200 °C, ale voda ešte nevrie. Navonok sa teda nedeje takmer nič. Situácia sa však dramaticky zmení práve pri teplote kritického bodu, keď náhle zmizne rozhranie medzi kvapalinou a jej parou, teda hladina vody. V tomto momente zaniknú aj obe skupenstvá vody a vznikne niečo úplne nové. Práve to sa nazýva supekritická voda.
Čo to teda vlastne je?
Superkritická voda je niečo medzi kvapalinou a plynom. Pripomeňme si vlastnosti obyčajnej vody. Tú tvoria molekuly vody, ktoré sú vďaka svojej polárnej povahe pospájané slabými, takzvanými vodíkovými väzbami. Práve tieto zoskupenia molekúl sú zodpovedné za to, že voda má vlastnosti, ktoré by pri rovnakej teplote a tlaku zodpovedali látke s omnoho ťažšími molekulami (napr. vysoká teplota varu). Keď hovoríme, že superkitická voda je niečo medzi kvapalinou a plynom, je to dosť prekvapujúce, pretože obe skupenstvá sa vo vlastnostiach výrazne líšia. Napríklad hustota vodnej pary je približne stotisíckrát menšia ako hustota vody. Takže ak sa nám zdá, že v našej nádobe sa pri ohrievaní takmer nič nedeje, nie je to pravda.
Roztrhnutie vodíkových väzieb

Pri vzniku superkritickej vody sa menia aj chemické vlastnosti našej obyčajnej vody. Je to zapríčinené tým, že pri tejto premene dochádza k postupnému zmenšovaniu veľkých zhlukov molekúl, ich usporiadania a zároveň aj k zmene charakteru spôsobu väzieb medzi nimi. Táto zmena je postupná, takže napríklad vlastnosti vody pri 150 °C rozhodne nie sú rovnaké ako pri 300 °C. V oblasti kritického bodu dochádza k úplnému roztrhnutiu vodíkových väzieb, takže jednotlivé molekuly sa stávajú navzájom izolovanými. No aj vlastnosti superkritickej vody závisia od tlaku a teploty. Zatiaľ čo pri bežnej vode sme zvyknutí na to, že sa v nej dobre rozpúšťajú rôzne zlúčeniny iónovej povahy (napr. kuchynská soľ), pri superkritickej vode je to naopak: rozpúšťa nepolárne látky, teda tie, s ktorými si kvapalná voda nevie poradiť. Aj chemické reakcie v nej prebiehajú úplne inak, čo sa prejavuje napríklad aj v tom, že zliatiny nekorodujúce v kvapalnej vode sú často pre supekritickú vodu bezbranným sústom.
Zmena tepelnej kapacity
Jednou z ďalších vlastností, ktoré sa výrazne menia v okolí kritického bodu, je tzv. hmotnostná tepelná kapacita, čo je teplo potrebné na zvýšenie teploty jedného kilogramu látky o jeden kelvin (resp. o stupeň Celzia). Od tejto veličiny závisí napríklad tepelná zotrvačnosť látok, ktorá hovorí o tom, aké množstvo tepla dokáže látka v sebe akumulovať a zároveň ho aj postupne uvoľňovať. Obyčajná voda má pomerne veľkú tepelnú kapacitu – aj vďaka tejto vlastnosti máme na našej planéte život. Obmedzuje totiž výrazné výkyvy teplôt súvisiace s rotáciou Zeme okolo vlastnej osi a s jej pohybom okolo Slnka. V okolí kritického bodu sa aj táto vysoká tepelná kapacita zvyšuje na takmer 50-násobok. Preto sa využíva na chladenie alebo ohrev v rôznych energetických blokoch.
Vlastnosti plynu aj kvapaliny
Superkritická voda je zvláštny typ hustého plynu, čo znamená, že má niektoré vlastnosti plynu a kvapaliny. Pri rôznych chemických reakciách sa výhodne uplatňuje napríklad jej nízka viskozita (oproti kvapaline). Superkritická voda sa využíva na oxidáciu nebezpečných kvapalných organických odpadov pomocou peroxidu vodíka (ako oxidovadla). Nízka viskozita vody tesne pod jej kritickým bodom je tiež výhodu pri extrakcii rôznych organických látok. Obrovskou výhodou je, že na rozdiel od konkurenčných organických rozpúšťadiel nie je toxická. Takto sa využíva napríklad pri dekontaminácii pôdy a rôznych znečistených sedimentov.

Superkritické sušenie a aerogély
Nezvyčajná zmena vlastností kvapalín počas ich premeny na superkritický stav sa využíva pri tzv. superkritickom sušení. Do tohto stavu možno dostať nielen vodu, ale aj iné kvapaliny. Rozdiel je najmä v tom, pri akých teplotách k tomu dochádza. Napríklad etanol má kritickú teplotu 241 °C a kritický tlak 6,3 kPa. Oxid uhličitý však iba 31,04 °C a 7,38 kPa. Výber týchto dvoch látok nie je náhodný, pretože pri superkritickom sušení sa z rôznych tuhých látok často odstraňujú práve tieto.
Superkritická voda je zvláštny typ hustého plynu, čo znamená, že má niektoré vlastnosti plynu aj kvapaliny.
Uvedená metóda sa využíva pri tuhých látkach náchylných na kolaps štruktúry v dôsledku pôsobenia kapilárnych síl. Tie sa uplatňujú vtedy, keď sa vo veľmi malých póroch sušenej látky súčasne nachádza kvapalina spolu s jej parami. Ak teda tuhú látku pripravíme v kvapaline (ktorú treba z tuhej látky odstrániť), prevedieme túto kvapalinu do superkritického stavu a potom ju znížením tlaku zmeníme na plyn, vyhneme sa problému zrútenia štruktúry tuhej látky. Stojí to síce veľa úsilia, ale výsledkom môže byť získanie mimoriadne pórovitých látok, ktoré sa volajú aerogély. Niektorými fyzikálnymi vlastnosťami sa približujú k plynom, hoci ide o tuhé látky. To súvisí s tým, že hlavnú časť ich objemu tvorí práve plyn.
Text a foto prof. Ing. Karol Jesenák, CSc.
Prírodovedecká fakulta Univerzity Komenského v Bratislave