O minuloročnú Nobelovu cenu za chémiu sa historicky prvýkrát podelili dve dámy – francúzska profesorka a výskumníčka v oblastiach mikrobiológie, genetiky a biochémie Emmanuelle Charpentierová (1968) a americká biochemička a molekulárna biologička Jennifer Doudnová (1964).

Vyslali tým navonok silný signál, ktorý po oznámení Nobelovej ceny komunikovali aj cez sociálne siete: Želáme si, aby naše víťazstvo bolo vnímané ako pozitívna správa pre mladé dievčatá, ktoré by sa rady vydali cestou vedeckého výskumu, a aby sa ukázalo, že aj ženy vo vede majú vplyv cez výskum, ktorý realizujú.
Osudové stretnutie
Tento príbeh sa začal v kaviarni v meste San Juan v Portoriku v roku 2011, kde sa počas mikrobiologickej konferencie stretli Emmanuelle Charpentierová a Jennifer Doudnová. Aj keď sa vtedy osobne nepoznali, rozhodli sa spolu preskúmať mesto. Niekto by sa rozprával o počasí a jedle, ale tieto dve vedkyne spájal obrovský záujem o fascinujúci a doposiaľ neprebádaný bakteriálny obranný systém s názvom CRISPR/Cas9. A tak sa debata niesla najmä v duchu toho, čo všetko o ňom ešte nie je známe a ako ho spoznať lepšie. V roku 2012 predstavili svoj objav a potom sa ich cesty rozišli. O neuveriteľne krátku dobu, len deväť rokov, sa podelili o Nobelovu cenu za chémiu. E. Charpentierová prijala hovor zo Štokholmu oznamujúci ocenenie vo svojej kancelárii v Berlíne a označila ho za veľmi emotívny. Vtipným spôsobom sa o ocenení dozvedela J. Doudnová. Nadránom niečo pred treťou jej zazvonil telefón a na opačnej strane bola reportérka časopisu Nature. Chcela komentár k Nobelovej cene a J. Doudnová sa jej opýtala, kto ju vlastne získal, keď k tomu má dať komentár. A reportérka jej na to odpovedala: No vy!
Čo je CRISPR
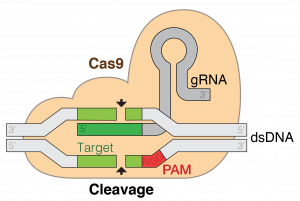
V roku 1993 narazil španielsky molekulárny biológ a mikrobiológ Francisco Mojica (1963) v DNA mikroorganizmov na niečo neočakávané – zvláštne sa opakujúce jednotky bez zjavnej funkcie. Zistil, že tieto pozoruhodné sekvencie sú rozšírené v mikróboch. Získali skratku CRISPR z anglického Clustered Regularly Interspaced Short Palindromic Repeats, teda zoskupené pravidelne rozložené krátke palindrómové opakovania. Mojica zistil, že sekvencie zodpovedajú DNA z fágov, vírusov infikujúcich baktérie. Prišiel s ideou, že CRISPR zabezpečuje bakteriálnu imunitu proti vírusom tak, že zabezpečí štiepenie vírusovej DNA a tým jej nefunkčnosť. Pre vedeckú komunitu bol tento nápad šialený. Aby baktérie mali imunitu, ktorú majú dokonca zakódovanú v genóme? Výsledky Francisca Mojicu boli napokon prijaté a publikované až v roku 2005. Zistilo sa, že pri štiepení vírusovej DNA hrajú kľúčovú úlohu ďalšie dva elementy – malé RNA (crRNA) a endonukleáza (štiepiaci enzým) Cas9. Detaily fungovania tohto systému však vyvolávali čoraz viac otázok.
Úspešné hľadanie

Charpentierová začala s výskumom CRISPR koncom roku 2000. Práve sa presťahovala z Viedenskej univerzity v Rakúsku na univerzitu v Umeå v severnom Švédsku. Venovala sa štúdiu baktérie Streptococcus pyogenes, ktorá spôsobuje tonzilitídu, infekcie kože, ale aj zápal pľúc a život ohrozujúcu sepsu. E. Charpentierová chcela zistiť, ako tento a ďalšie mikróby vytvárajú rezistenciu na antibiotiká, a to práve skúmaním malých molekúl RNA, ktoré regulujú expresiu génov. Vo svojom výskume našla prepojenie malých molekúl RNA práve s CRISPR. Spolu s kolegami odhalili, že nevyhnutnou súčasťou procesu štiepenia DNA pomocou systému CRISPR/Cas9 sú transkódované malé RNA tzv. tracrRNA. Tak identifikovali chýbajúcu aktivačnú dráhu, ktorá bola založená na interakcii medzi tracrRNA a crRNA. Bol to veľký objav vysvetľujúci mechanizmus aktivity systému CRISPR/Cas9. Bolo to v roku 2011 a E. Charpentierová sa chystala na mikrobiologickú konferenciu v Portoriku hľadať pomoc štruktúrneho biológa, ktorý by jej pomohol dešifrovať štruktúru Cas9. Jennifer Doudnovú lákali CRISPR ako fascinujúci záhadný fenomén. Mala skvele rozbehnutú vedeckú skupinu na Kalifornskej univerzite v Berkeley. CRISPR sa začala venovať v roku 2006 ako malému zábavnému vedľajšiemu projektu napriek tomu, že v tom čase nevidela priame prepojenie vtedy kontroverznej bakteriálnej imunity s ľudským zdravím. Na stretnutí v Portoriku v roku 2011 si E. Charpentierová a J. Doudnová veľmi rýchlo uvedomili svoju doplňujúcu sa vedeckú odbornosť. E. Charpentierová sa pozerala na CRISPR cez zdraviu škodlivé baktérie a J. Doudnová najmä cez RNA a jej úlohu vo vývoji života.
Spojiť sa je dôležité
Len čo sa obe vrátili do svojich laboratórií, začali spolupracovať – J. Doudnová a jej tím na západnom pobreží USA a E. Charpentierová s jej kolegami sa rozdelili medzi Švédsko a Rakúsko. Pochopili, že je dôležité spojiť sily a že musia postupovať rýchlo, pretože príbeh bol fascinujúci, skvelý a najmä plný konkurencie. Nasledovali nekonečné e-maily a online rozhovory cez Atlantik. V dôsledku časového posunu bola spolupráca nielen intenzívna, ale údajne takmer nepretržitá. Spočiatku experimenty nefungovali. Kombinácia purifikovaného proteínu Cas9 a kúska crRNA neurobila nič. No len čo do zmesi pridali tracrRNA, zrazu sa to rozbehlo. Ukázalo sa, že tracrRNA nehrala iba úlohu pri aktivácii systému, bola tiež potrebná na jeho plynulý chod. A potom prišla revolučná myšlienka, ktorá doslova zmenila svet. Vieme Cas9 naprogramovať tak, aby štiepila tam, kde chceme? Čo ak by Cas9 mohla fungovať aj v bunkách vyšších organizmov a dokonca ľudských bunkách? Ako urobiť tento systém nielen funkčným v bunkách vyšších organizmov, ale aj jednoduchým? A tak tímy spojili crRNA a tracrRNA do jednej molekuly, sekvencie 20 párov báz, ktorá sa nazýva vodiaca RNA. Do polroka od zverejnenia výsledkov tohto výskumu ďalší vedci, čínsko-americký biochemik Feng Zhang (1981) pôsobiaci v Broad Institute na MIT a americký genetik, molekulárny inžinier a chemik George Church (1954) potvrdili, že to, čo navrhli ich kolegyne, skutočne funguje, a dokonca na nebakteriálnych bunkách. F. Zhang, G. Church a J. Doudnová ukázali, že pre CRISPR/Cas9 neexistujú druhové obmedzenia a že tieto genetické nožnice fungujú rovnako dobre v myších aj v ľudských bunkách. Tento objav bol revolučný. Hoci genetické inžinierstvo nebolo nič nové, CRISPR/Cas9 umožnil vedcom manipulovať s DNA na úplne novej úrovni, čo sa týka presnosti, pričom tento proces bol jednoduchší, lacnejší a rýchlejší. Po predstavení objavu E. Charpentierová pokračovala v skúmaní CRISPR/Cas9 pri baktériách, ktoré sú zodpovedné za choroby u ľudí, a J. Doudnová vo svojom štúdiu mechanizmov spojených s CRISPR.
Objav zachraňujúci životy
Existuje obrovské úsilie vyvinúť CRISPR/Cas9 tak, aby bol bezpečným biomedicínskym nástrojom na klinické aplikácie. E. Charpentierová aj J. Doudnová založili niekoľko startupových spoločností zameraných na komercializáciu tejto technológie. V novembri 2018 dostala J. Doudnová e-mail, v ktorom bolo ako predmet uvedené Narodili sa deti. E-mail odoslal čínsky vedec He Jiankui a oznamoval v ňom, že sa podieľal na klinickej štúdii, v ktorej použili CRISPR/Cas9 na vykonanie zmien v genóme detí. U týchto detí narušil gén CCR5, ktorý umožňuje infikovanie buniek infekciou HIV. Pretože sa deti narodili HIV pozitívnemu otcovi, chcel ich takýmto spôsobom pred HIV infekciou ochrániť. Vedecká komunita to rázne odsúdila. Jiankui bol v decembri 2019 odsúdený za nelegálnu lekársku prax na tri roky väzenia. Napriek tomu, že takýto škandál vystrašil širokú verejnosť, CRISPR/Cas9 zaznamenal aj množstvo úspechov. V minulom roku liečili v USA prvú osobu s genetickým ochorením nazývaným kosáčikovitá anémia terapiou založenou na CRISPR/Cas9. Pacientka dostala transplantáciu kostnej drene, ktorá obsahovala jej vlastné bunky upravené tak, aby produkovali hemoglobín a kompenzovali tak stratu hemoglobínu spôsobenú vrodenou chybou v géne kódujúcom hemoglobín. Aj keď na vyhodnotenie úspešnosti liečby si musíme počkať dlhšie, pacientka po absolvovaní tejto liečby doposiaľ nepotrebovala ďalšie transfúzie krvi. Klinickú aplikáciu CRISPR/Cas9 však komplikuje patentový spor medzi dvoma laureátkami zastupovanými Kalifornskou univerzitou v Berkeley a F. Zhangom z Broad Institute. Aj keď Berkeley požiadala o patent na použitie CRISPR/Cas9 v bezbunkových systémoch skôr, Broad Institute získal patent na použitie tejto techniky v nebakteriálnych bunkách. Doposiaľ boli ponechané oba patenty, spor však naďalej trvá. E. Charpentierová a J. Doudnová však zdôrazňujú, že CRISPR/Cas9 je dokonalým príkladom toho, ako riešenia prichádzajú mnohokrát z úplne neočakávaných miest.
MUDr. RNDr. Dominika Fričová, PhD.
Neuroimunologický ústav SAV v Bratislave