Poviete si, čo to už môže byť za vedu okolo ľadu. No voda nie je iba taká jednoduchá zlúčenina.
Rozdiely medzi skupenstvami (fázami) sú univerzálne, nemusí ísť iba o vodu. Molekuly takmer všetkých látok majú veľkosť desatín nanometra.
Tri skupenstvá
Pri dostatočne vysokých teplotách sa molekuly pohybujú tak rýchlo, že akékoľvek interakcie medzi nimi sú zanedbateľné. Molekuly lietajú priestorom, narážajú do seba a ich vzdialenosti sú zväčša v nanometroch. V tomto prípade hovoríme o plyne. Keď znížime teplotu, teda rýchlosť molekúl, drobné sily medzi molekulami dokážu udržať častice ako-tak pohromade. Budú natesno, ale v tomto dave si každá molekula zachová individualitu a vie sa v ňom pohybovať samostatne. Vtedy ide o kvapalinu. Pri nižších teplotách nie je energia molekúl dostatočná na to, aby prekonala medzimolekulové sily. Molekuly sa uložia do mriežky, kde má každá svoje pevné miesto a nedokáže sa pohybovať ako jednotlivec. Dostávame sa k pevnému skupenstvu. Voda je medzi zlúčeninami špecifická tým, že okrem bežných, veľmi slabých medzimolekulových síl existuje medzi dvoma molekulami vody ďalší druh silnejšej príťažlivej sily. Hovorí sa mu vodíkový mostík, pričom vodík v jednej molekule sa vie naviazať na kyslík v druhej. Mechanizmus tejto interakcie je trochu komplikovanejší – zdôraznime len, že je iný ako chemická väzba, ktorá drží pohromade atómy kyslíka a vodíka priamo v molekule.
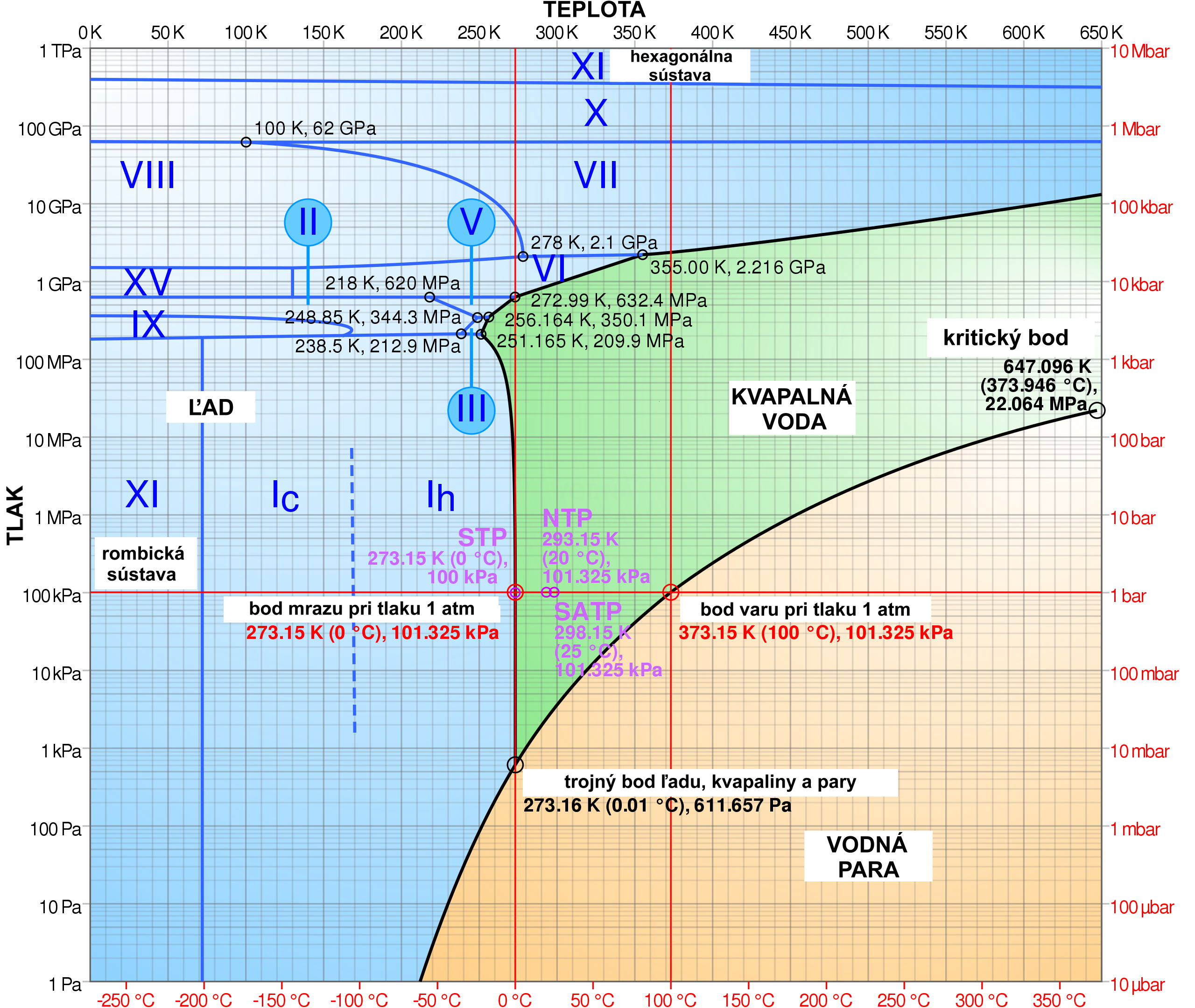
Fázový diagram vody, ktorý ukazuje, v akej fáze sa pri danej teplote a danom tlaku bude voda nachádzať, ilustrácia wikipédia/Cmglee
Bežná forma
Pre tú istú látku môže mriežka, v ktorej sa molekuly ocitnú, vyzerať rôzne a usporiadania môžu mať odlišné vlastnosti. Tak napríklad ľad, ktorý si pridávame do nápoja, má technické označenie Ih (čítaj jedna há). Kyslíky sú v ňom usporiadané do hexagonálnej mriežky a molekuly sú každým vodíkom otočené na niektorý zo susedných kyslíkov. Ako to vieme? Všetok ľad, ktorý vzniká pri podmienkach bežných na Zemi, má takúto štruktúru. To však nie je jediné možné usporiadanie molekúl vody. Je to podobné, ako keď sa usilujeme usporiadať hŕbu pomarančov. Môžeme ich naukladať do pyramídy ako v supermarkete, ale môžeme byť kreatívnejší. Napríklad možno šesťuholníkové vrstvy pyramídy uložiť na seba tak, že pomaranče budú stáť na sebe a nie v medzerách nižšej vrstvy. Alebo spravíme štvorcové, a nie šesťuholníkové vrstvy.
Od výmyslu sveta
Existuje 18 rôznych konfigurácii molekúl vody v pevnej fáze. Napríklad ľad Ic, ktorý sa v malých množstvách vyskytuje v horných vrstvách atmosféry, má kyslíky usporiadané do pyramídovej štruktúry, ako už spomínané pomaranče v supermarkete. To, ako presne štruktúra vyzerá, určujú podmienky (teplota a tlak), pri akých sa ľad nachádza, ale aj podmienky, pri akých voda mrzla, a substrát, na ktorom k tomu dochádzalo. Pri rôznych vonkajších podmienkach je pre molekuly vody výhodné zaujať rôzne usporiadanie, všetko v dôsledku medzimolekulových interakcií riadených vodíkovými mostíkmi. Niektoré usporiadania sú metastabilné, čo znamená, že síce držia, ale aj maličká zmena zvonku ich naruší. Rôzne druhy ľadu sa líšia hustotou a inými mechanickými vlastnosťami. Ak napríklad pri teplote 0 °C vodu stláčame, pri tlaku asi 10 000 atmosfér vznikne ľad VI, v ktorom sú molekuly usporiadané tetragonálne. Ak ho stlačíme ešte viac, vznikne ľad VII s kubickou mriežkou. To, že ide o aktívnu oblasť výskumu, dokazuje, že posledná forma ľadu, tzv. štvorcový ľad, bola prvýkrát pripravená v roku 2014.
Juraj Tekel
Fakulta matematiky, fyziky a informatiky
Univerzita Komenského v Bratislave
Viac podobných článkov nájdete na stránke vedator.space.