Diagnostika onkologických ochorení zostáva v popredí súčasného medicínskeho výskumu rovnako ako znižovanie vedľajších účinkov liekov. Hľadajú sa nekonvenčné riešenia liečby, ktoré budú dostupné.
Diagnostika onkologických ochorení zostáva v popredí súčasného medicínskeho výskumu rovnako ako znižovanie vedľajších účinkov liekov. Hľadajú sa nekonvenčné riešenia liečby, ktoré budú dostupné.
Uhlík je základom pre život na Zemi, keďže sa ako stavebná jednotka podieľa na všetkých organických zlúčeninách. Využíva sa hlavne v energetike, ale produkty spracovania ropy sú neodmysliteľnou súčasťou každodenného života. Okrem toho sa nachádza ako minerál v prírode a záleží na type kryštalizácie, podľa ktorej má formu diamantu a vysokú tvrdosť alebo, naopak, mäkkosť a formu grafitu využívanú v ceruzkách.
Zaujímavý grafit
Pre náš výskum je zaujímavá práve forma grafitu. Kryštalizuje vo vrstvách, medzi ktorými sú Van der Wallsove väzby. Patria medzi slabé chemické väzby a vďaka nim sa dá písať uhlíkom/grafitom ako tuhou ceruzky. Prechádzaním po papieri sa jednotlivé vrstvy od seba oddeľujú a zostávajú na papieri. Oproti slabým väzbám, ktoré držia vrstvy pri sebe, sú jednotlivé vrstvy tvorené štruktúrou šesťuholníkov pripomínajúcimi včelí plást. V roku 2004 sa podarilo jednotlivé vrstvy oddeliť a v roku 2010 získali Andrej Geim a Konstantin Novoselov za objav grafénu Nobelovu cenu. Odvtedy vzrástol záujem o grafén čiže monovrstvu grafitu a jeho modifikácie. Keďže ho tvorí len uhlík v šesťuholníkovej štruktúre, predpovedali mu vynikajúce možnosti využitia – a tie sa väčšinou potvrdili. Možným využitím sa zaoberali aj vedci Ústavu polymérov v spolupráci s Fyzikálnym ústavom, Ústavom experimentálnej fyziky a Virologickým ústavom Biomedicínskeho centra Slovenskej akadémie vied.
Detekcia rakoviny
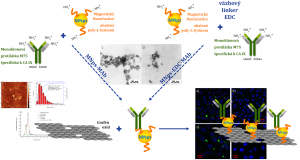
 Rakovina je jedným z najzákernejších ochorení. Vedci sa usilujú o jej skorú detekciu, ale aj o liečbu bez vedľajších účinkov. Odpoveďou na skorú detekciu môže byť aj grafén oxid s nanočasticami železa a protilátkami. Čo je vlastne grafén oxid (GO)? Ide o oxidovanú formu grafénu. Po jeho oxidácii sa na povrchu tvoria reaktívnejšie skupiny kyslíka a vzniká grafén oxid. Grafén oxid pripravený na Ústave polymérov pomocou upravenej reakcie pomenovanej podľa jej objaviteľov Williama S. Hummersa a Richarda E. Offemana bol po exfoliácii z práškového grafitu upravený ultrazvukom a centrifugovaný, aby sa oddelili a získali monovrstvy – jednoatomárne vrstvy grafén oxidu. Tie boli ďalšími reakciami upravované tak, aby sa napojili nanočastice železa a protilátky. Grafén oxidová nanoplatforma slúži ako nosič pre nanočastice železa a protilátku. Okrem tých však môže viazať na svoj povrch aj iné komponenty, napríklad liečivá.
Rakovina je jedným z najzákernejších ochorení. Vedci sa usilujú o jej skorú detekciu, ale aj o liečbu bez vedľajších účinkov. Odpoveďou na skorú detekciu môže byť aj grafén oxid s nanočasticami železa a protilátkami. Čo je vlastne grafén oxid (GO)? Ide o oxidovanú formu grafénu. Po jeho oxidácii sa na povrchu tvoria reaktívnejšie skupiny kyslíka a vzniká grafén oxid. Grafén oxid pripravený na Ústave polymérov pomocou upravenej reakcie pomenovanej podľa jej objaviteľov Williama S. Hummersa a Richarda E. Offemana bol po exfoliácii z práškového grafitu upravený ultrazvukom a centrifugovaný, aby sa oddelili a získali monovrstvy – jednoatomárne vrstvy grafén oxidu. Tie boli ďalšími reakciami upravované tak, aby sa napojili nanočastice železa a protilátky. Grafén oxidová nanoplatforma slúži ako nosič pre nanočastice železa a protilátku. Okrem tých však môže viazať na svoj povrch aj iné komponenty, napríklad liečivá.
Prečo práve nanočastice železa (MNps)? Hneď z dvoch dôvodov: jedným je možnosť ich detekcie v ľudskom tele pomocou magnetickej rezonancie a druhým je ich využitie pri nekonvenčnej liečbe. Nanočastice železa pre náš výskum pripravili v Ústave experimentálnej fyziky v Košiciach. Príprava prebiehala v zásaditom roztoku vyzrážaním oxidov železa. Takto získané magnetitové častice sa následne obalili proteínom, aby boli biokompatibilné pre bunky a v neskoršom štádiu výskumu aj pre ľudské telo. Posledným spomínaným komponentom sú protilátky, špecifické k rakovinovému enzýmu karbonická anhydráza IX. Ten produkujú bunky v prípade, že sa bunka nachádza v hypoxii. Ide o nedostatočné okysličenie buniek z toho dôvodu, že rakovina pri svojom bujnení v organizme spôsobuje rýchle množenie buniek, ale vlásočnice a cievy nerastú rovnako rýchlo. Tento fenomén je pozorovaný pri väčšine onkologických ochorení. Karbonickú anhydrázu IX detailne popísal tím vedcov pod vedením prof. Silvie Pastorekovej na Virologickom ústave Biomedicínskeho centra. Použité protilátky sa nazývajú monoklonové (MAb) a dokážu sa viazať len na jedno špecifické miesto enzýmu karbonická anhydráza IX. To má za následok, že na rozdiel od iných metód, napríklad chemoterapie, nie sú zasiahnuté zdravé bunky.
Výsledok
V tomto štádiu výskumu sa podarilo pripraviť rôzne funkcionalizovanú nanoplatformu grafén oxidu, čiže nosiča pre magnetické nanočastice a monoklonové protilátky. Nosič sa testoval v prostredí buniek, ktoré mali enzým karbonickú anhydrázu IX, ale aj v prostredí buniek bez tohto enzýmu. Dôvodom bolo otestovanie špecifického naväzovania, teda detekcie nádorových buniek nami pripraveným nosičom. Špecificita bola potvrdená rozdielom 50 %. Kvantitatívne sa podarilo stanoviť, že 50 % živých buniek s enzýmom obsahovalo aspoň jeden naviazaný nosič, oproti 6 % živých buniek bez enzýmu, ktoré obsahovali aspoň jeden naviazaný nosič. Rozdiel je v tomto prípade očividný, a tím vedcov naďalej pracuje na vylepšení špecifického naviazania nosiča na nádorové bunky.
Text a foto Ing. Nikola Bugárová
Ústav polymérov SAV v Bratislave
V spolupráci s Mladí vedci SAV
Ak chcete mať prístup aj k exkluzívnemu obsahu pre predplatiteľov alebo si objednať tlačenú verziu časopisu Quark, prihláste sa alebo zaregistrujte.