
V tomto roku si pripomíname 100. výročie objavu fotokatalytických vlastností oxidu titaničitého (TiO2). Hlavná časť ich praktického využitia sa tradične sústreďuje najmä na dezinfekciu a dekontamináciu vôd. Čistenie cirkulujúceho vzduchu vnútorných priestorov budov však predstavuje relatívne moderné využitie.
Náš predchádzajúci článok o oxide titaničitom (pozri Quark 12/2020) hovoril o tých jeho aplikáciách, s ktorými sa stretávame v bežnom živote takmer na každom kroku. Všetky mali jedno spoločné, týkali sa výlučne využitia jeho dvoch syntetických polymorfných modifikácií anatasu a rutilu v podobe bieleho pigmentu. Z významných vlastností týchto látok boli zámerne vynechané ich fotokatalytické vlastnosti, ktoré s problematikou pigmentov môžu, ale aj nemusia súvisieť.
Čo je fotokatalyzátor
Katalyzátor je zväčša pevná látka, ktorá výrazne urýchľuje chemickú reakciu bez toho, aby sa sama pri tejto reakcii spotrebúvala. Toto zrýchlenie je často také veľké, že bez použitia katalyzátora príslušná reakcia takmer vôbec neprebieha.

Na rozdiel od katalyzátora, fotokatalyzátor urýchľuje reakciu iba vtedy, keď je reakčná zmes spolu s katalyzátorom osvetľovaná nejakým typom žiarenia. Môže to byť napríklad žiarenie vo viditeľnej oblasti svetla alebo ultrafialové (UV) žiarenie. V oboch prípadoch medzi katalyzátorom a zdrojom žiarenia nemôže byť neprekonateľná prekážka, čo v prípade UV žiarenia môže byť napríklad aj obyčajné priehľadné sklo. Najvýznamnejšou fotokatalytickou reakciou oxidu titaničitého je oxidácia.
TiO2 a životné prostredie
K syntetickému oxidu titaničitému vedú tri hlavné kroky. Prvým je ťažba hornín obsahujúcich ilmenit (FeTiO3), prípadne rutil alebo anatas. Druhým je separácia týchto minerálov v podobe koncentrátu a tretím krokom je jeho chemické spracovanie (bližšie je spomenuté v Quarku 12/2020). Je to teda podobné ako v prípade iných látok vyrábaných z primárnych anorganických surovín. Podobné sú aj niektoré negatívne dôsledky tejto výroby s tým rozdielom, že hlavné zdrojové minerály patria na stupnici zdravotnej rizikovosti k úplne posledným.

Oxid titaničitý patrí k nemnohým látkam, ktoré svoju výrobu môžu kompenzovať celkom zaujímavým príspevkom k zlepšeniu životného prostredia. Prelomovým krokom v histórii skúmania tejto látky totiž nebol ani tak objav jej katalytických vlastností v roku 1921, ako skôr zistenie, že ich možno využiť pri rozklade niektorých polutantov a zároveň pri ničení rôznych mikroorganizmov. (Prvé sa datuje do roku 1976, druhé do roku 1985.) Odvtedy postupne začalo rásť aj praktické využívanie tejto fotokatalýzy v oblasti ochrany životného prostredia a to pokračuje až doteraz. Jej podstatou je oxidácia organických látok.
Ako to funguje
Katalytická reaktivita povrchu oxidu titaničitého súvisí s jeho polovodivými vlastnosťami. Za aktiváciu povrchu zodpovedá tvorba negatívneho a kladného náboja jeho povrchu v dôsledku excitácie elektrónov z tzv. valenčného do vodivostného pásu.
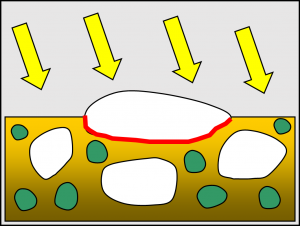
Energia zodpovedajúca tomuto prechodu predstavuje pri čistom anatase 3,2 eV (elektrónvoltu), čo znamená, že tieto elektróny možno excitovať UV žiarením s vlnovými dĺžkami pod hranicou 385 nm. Následná oxidácia organických molekúl je výsledkom niekoľkých reakcií. Primárnou je tvorba radikálov a skupín atómov obsahujúcich kyslík na povrchu fotokatalyzátora (O2- a ·OH). Tie následne vzájomne reagujú za tvorby peroxidu vodíka (H2O2), molekulárneho kyslíka (O2 ) a prípadne aj ďalších radikálov obsahujúcich kyslík. Nutnou podmienkou pre priebeh týchto reakcií je však prítomnosť molekúl vody, čo znamená, že reakcia musí prebiehať buď vo vodných roztokoch, alebo v plynnej fáze s obsahom aspoň minimálneho množstva vodných pár.
Všeobecný problém eliminácie negatívnych účinkov mikroorganizmov a rôznych organických látok spočíva v tom, že ide o veľmi rôznorodé spektrum substancií.
Z toho vyplýva, že na ich zneškodnenie potrebujeme zvyčajne rôzne metódy. Práve veľkou výhodou fotokatalýzy je, že ju možno využiť vo všetkých prípadoch. Konečnými hlavnými produktmi oxidácie organických molekúl sú voda a oxid uhličitý. Najčastejšími vedľajšími produktmi môžu byť oxidy dusíka. Reakcia teda vedie k výraznému zníženiu zdravotných rizík v porovnaní s rizikami súvisiacimi s pôvodnými organickými látkami.
Prospešná oxidácia
Táto oxidácia je v niečom podobná katalytickému spaľovaniu automobilových výfukových plynov, pri ktorom sa rozkladajú nebezpečné produkty nedokonalého spaľovania benzínu na vodu, oxid uhličitý a oxidy dusíka. Tieto deje prebiehajú v tzv. oxidačnej časti automobilového katalyzátora.

Je tu však aj niekoľko podstatných rozdielov. Prvým je ten, že v prípade oxidácie výfukových plynov nejde o fotokatalýzu, ale klasickú katalýzu na nanočasticiach platiny a paládia viazaných na povrchu keramických pórovitých matríc. Druhý rozdiel predstavuje výrazne rozdielna teplota, pri ktorej tieto reakcie prebiehajú. Kým v prípade TiO2 sú to zväčša bežné teploty v intervale 20 až 30 °C, pri autách sa pohybujú od 300 do 800 °C. S týmto rozdielom súvisí aj výrazne väčšia účinnosť automobilových katalyzátorov. Tu je potrebné poznamenať, že katalyzátory na báze oxidu titaničitého sú všeobecne určené na riešenie problému relatívne nízkych úrovní kontaminácie. Jednou z výhod, ktorá sa týka predovšetkým čistenia vôd, je, že tento typ oxidácie, na rozdiel od tradičnej chlorácie, neprodukuje rôzne nebezpečné chlórované deriváty uhľovodíkov.
Eliminácia druhej skupiny substancií zahrňujúcej už spomenuté mikroorganizmy zasa spočíva v poškodzovaní organických molekúl ich stavebných štruktúr. Vďaka tomu sa stávajú neaktívne, a teda nie sú schopné rozmnožovať sa. Týka sa to predovšetkým vírusov, baktérií a plesní.
Rutil alebo anatas?
Pri porovnávaní katalytických vlastností víťazí anatas nad rutilom. Je to teda podobné ako v prípade porovnávania optických vlastností pigmentov. Týmto konštatovaním sa však toto porovnanie nedá tak jednoducho odbiť.

Totiž, kým v prípade pigmentov toto víťazstvo nie je celkom jednoznačné, tak v prípade fotokatalyzárorov ide o jasnú prevahu anatasu. Prečo je to tak? Pri pigmentoch totiž záleží hlavne na tom, aby dobre vyzerali. Tieto vlastnosti zabezpečuje najmä vysoký index lomu, veľký rozptyl svetla na časticiach pigmentu a čo najnižší obsah farebných prímesí. Rutil s anatasom sa v tomto ohľade síce líšia, no rozdiely nie sú veľmi výrazné. Preto priemyselne vyrábané pigmenty väčšinou nemusia obsahovať iba jeden typ minerálu, z rôznych dôvodov môže byť výhodnejší väčšinový obsah buď anatasu, alebo rutilu. Kým pri pigmentoch záleží na tom, ako vyzerajú, pri fotokatalyzátoroch je to asi to posledné, na čom záleží.
Víťazstvo anatasu vo fotokatalytických aplikáciách súvisí predovšetkým s rozdielmi v trvanlivosti kladného a záporného náboja jeho povrchu, vyvolaného žiarením. Tá je ovplyvňovaná tzv. rekombináciou elektrónov a kladných dier ich kryštálovej mriežky.
Text a foto prof. Ing. Karol Jesenák, CSc.
Prírodovedecká fakulta
Univerzita Komenského v Bratislave






