Atómy sú veľmi maličké a nemáme šancu vidieť ich ani voľným okom, ani najlepším mikroskopom. Napriek tomu majú svoju štruktúru a má zmysel pýtať sa na ich tvar.
Atómy určite nevyzerajú tak, ako ukazuje úvodný obrázok. Elektróny riadi kvantová mechanika a v dôsledku princípu neurčitosti nemôžeme hovoriť o ich presnej polohe. Vieme hovoriť iba o pravdepodobnosti nájsť elektróny alebo niektorý z elektrónov na danom mieste. Ďaleko od stredu atómu je táto pravdepodobnosť takmer nulová, od istej vzdialenosti však začne narastať. To dáva obraz atómu ako guľôčky, ktorý často vidíme vo vyobrazeniach molekúl – je to oveľa presnejšie, ale ešte nie úplne ono. Miesta, kde je veľká pravdepodobnosť nájsť elektrón, majú komplikovanejšiu štruktúru.
Elektrónové orbitály
Prečo vlastne hovoríme iba o elektrónoch? Lebo tie majú najvýznamnejší vplyv na tvar atómov. Napriek tomu, že jadro každého atómu je o niekoľko rádov ťažšie ako jeho elektrónový obsah, je veľmi maličké a v porovnaní s priestorom, ktorý zaberajú elektróny, úplne zanedbateľné.
Kvantová mechanika nám hovorí, že elektróny sa v atómoch môžu nachádzať iba vo veľmi špecifických stavoch. Hovoríme im orbitály, označujú sa číslom a písmenom, v poradí 1s, 2s, 2p, 3s, 3p, 3d a tak ďalej. Navyše p orbitály existujú tri, d orbitálov je päť. Prečo to tak je a čo presne tieto čísla a písmená znamenajú, pre nás nebude teraz dôležité. Dôležitý bude tvar orbitálov a to, že elektróny ich postupne obsadzujú v poradí, v akom sú uvedené. A ešte jedna informácia – v konkrétnom atóme je v danom orbitáli miesto iba pre dva elektróny, ďalšie sa už musia zmestiť inam.
Sférická symetria
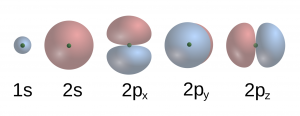
Poďme postupne skladať atómy s viac a viac elektrónmi. Prvý, s jedným elektrónom – vodík – bude mať obsadený orbitál 1s. Podľa obrázku je tento orbitál sféricky symetrický a atóm vodíka má guľový tvar. Dvojelektrónový atóm má v orbitáli 1s dva elektróny, je teda tiež guľový. Podobne to bude pre atómy s tromi a štyrmi elektrónmi, lebo orbitál 2s má takisto sférickú symetriu.
V atóme s piatimi elektrónmi sa však začnú diať veci. Piaty elektrón totiž obsadzuje niektorý z troch 2p orbitálov, ktoré majú zvláštny podlhovastý tvar. No ktorý si má vybrať? Samotné zákony kvantovej mechaniky sú sféricky symetrické a všetky tri možnosti sú úplne ekvivalentné. Elektrónu teda musí poradiť, ktorý orbitál si vybrať, niečo iné. Ak je atóm úplne izolovaný od čohokoľvek iného, nemá sa na základe čoho rozhodnúť a jednoducho obsadí všetky tri orbitály naraz. Hovoríme tomu superpozícia a je to možné opäť iba vďaka kvantovej mechanike – každý s pravdepodobnosťou jedna tretina. Dôležité je, že v tejto konfigurácii je usporiadanie miest s veľmi veľkou pravdepodobnosťou nájdenia roztrojeného elektrónu sféricky symetrické! A atóm je napriek predĺženému tvaru 2p orbitálov sféricky symetrický.
Jemnejšia štruktúra
Na Zemi však elektrón tento problém nemá. Symetriu medzi p orbitálmi ochotne narušia iné atómy v molekule, v atómovej mriežke, prípadne ďalšie vonkajšie vplyvy. Orbitály už nie sú dokonale rovnocenné a elektrón si má na základe čoho vybrať. A atóm dokonale symetrický nie je, pretože jeden z obsadených orbitálov má podlhovastý nesymetrický tvar.
Podobné argumenty sa opakujú pre atómy so šiestimi až deviatimi elektrónmi. Pri desiatich elektrónoch sa však stane niečo zaujímavé, podobné tomu s päťelektrónovým atómom v prázdnom vesmíre. 2p orbitály sú v takomto prípade plne obsadené a miesta, kde je veľmi veľká pravdepodobnosť nájsť elektróny, majú opäť sférickú symetriu. Desaťelektrónový atóm – atóm neónu – je opäť guľový.
To sa ďalej opakuje a vždy plne obsadená sada orbitálov vytvorí rozdelenie elektrónov, ktoré je sféricky symetrické napriek tomu, že samotné orbitály také nie sú.
Aký majú teda tvar atómy? Sú približne sférické a ak sa na ne pozeráme z väčšej vzdialenosti, sú to v podstate guľôčky. Zblízka sa však v niektorých z nich začne vďaka štruktúre elektrónových orbitálov objavovať jemnejšia štruktúra.
Juraj Tekel
Fakulta matematiky, fyziky a informatiky
Univerzita Komenského v Bratislave
Viac podobných článkov nájdete na stránke vedator.space.






