V minulých dvoch číslach sme si povedali, ako ľudia zistili, z čoho sa skladá hmota. Teraz je na čase ukázať si, odkiaľ vieme, že najmenšie častice hmoty podliehajú úplne iným pravidlám, ako sme zvyknutí.
V minulých dvoch číslach sme si povedali, ako ľudia zistili, z čoho sa skladá hmota. Teraz je na čase ukázať si, odkiaľ vieme, že najmenšie častice hmoty podliehajú úplne iným pravidlám, ako sme zvyknutí.
Týmto pravidlám hovoríme kvantová mechanika a jej objav je príbehom prvej tretiny 20. storočia. Rovnako je to aj začiatok príbehu tej časti fyziky, ktorá má prívlastok moderná. Ako sme si však už zvykli, všetko sa začína oveľa skôr a niekde celkom inde.
Spektrá chemických prvkov
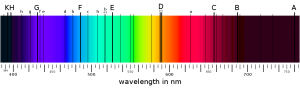
Prvým náznakom zvláštnych vlastností hmoty boli čiary v svetelnom spektre. Už antickí Rimania vedeli, že biele svetlo sa dá hranolmi rozložiť na farebné spektrum. V roku 1802 si anglický chemik William Wollaston (1766 – 1828) všimol, že slnečné spektrum má medzery – dúha, ktorú tvorí po prechode hranolom, nie je kompletná, ale na niektorých miestach sa nachádzajú tmavé pruhy. Tie neskôr dôkladne študoval bavorský fyzik Joseph von Fraunhofer (1787 – 1826), ktorého meno tieto čiary nesú. Podarilo sa mu prísť na spôsob, ako veľmi presne zmerať vlnovú dĺžku, a teda aj frekvenciu chýbajúceho svetla.
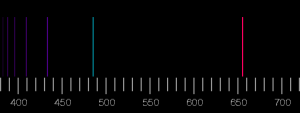
V druhej polovici 19. storočia chemici zistili, že ak do ohňa kahana vložíme chemikáliu, vo vzniknutom svetle sa na niektorých miestach začnú objavovať podobné čiary! Navyše, tieto čiary presne určujú, o akú chemikáliu ide. Pre každý prvok sú totiž rôzne, a niektoré zodpovedajú medzerám v slnečnom svetle. Išlo o veľmi dôležitý objav spektroskopie, pre nás však budú významné iba samotné čiary. Ako uvidíme, presné predpovedanie vlnových dĺžok spektrálnych čiar sa stalo kľúčovým testom teórií, ktoré mali ambíciu vysvetliť pravidlá a procesy vnútri atómov. Na konci 19. storočia boli vlastnosti týchto čiar pre mnohé prvky veľmi presne známe. Navyše, v roku 1885 švajčiarsky učiteľ matematiky Johann Balmer (1825 – 1898) objavil v čiarach prekvapivú štruktúru, charakterizovanú celými číslami. A ako sme si už zvykli, keď sa celé čísla objavia tam, kde by nemuseli, takmer vždy to poukazuje na čosi hlbšie.
Svetlo žiarovky
K zrodu kvantovej mechaniky viedol veľmi praktický problém, ktorý riešil nemecký fyzik Max Planck (1858 – 1947). Otázka znela: Ako presne vyzerá svetlo, ktoré vyžaruje rozžeravené vlákno žiarovky? Na konci 19. storočia bola žiarovka nový vynález a odpoveď na túto otázku priamo súvisela s jej efektívnym využívaním. M. Planck popisoval žiarenie pomocou pravidiel štatistickej fyziky a narazil na problém. Teoretický popis predpovedal, že žiarovka by vôbec nemala svietiť. Energia elektromagnetického žiarenia je úmerná jeho frekvencii, ultrafialové žiarenie má preto pri veľmi vysokej frekvencii aj veľmi vysokú energiu. Zo žiarovky by malo vychádzať žiarenie všetkých frekvencií. Keď žiarovku zahrievame, celá energia, ktorú vláknu dodáme, sa stratí vo vysokofrekvenčných módoch žiarenia a žiarovka nebude takmer vôbec svietiť. Iné, ale podobne absurdné tvrdenie by platilo pre žiarovku, ktorú sa nám nejakým zázrakom podarilo rozsvietiť. Pri akejkoľvek teplote vlákna bude svetlo žiarovky obsahovať obrovské množstvo ničivého žiarenia vysokých frekvencií – čím vyššia frekvencia, tým dokonca viac. Nič z toho sa však nedeje. Žiarovky svietia, ale nešíria ultrafialovú skazu. Niečo teda nie je v poriadku. A práve M. Planck v roku 1900 vyriešil tento problém tým, že podelil frekvencie svetla, ktoré žiarovka vyžaruje, na malé intervaly. Šírka týchto intervalov je daná konštantou, ktorá nesie jeho meno. V nich sa nemôže nachádzať ľubovoľne málo energie, a preto pri nedostatočnej teplote zostanú módy s vysokou frekvenciou chladné a bez energie. Z tohto predpokladu M. Planck odvodil výsledky v dobrej zhode s experimentálne určenými vlastnosťami vyžarovaného žiarenia, ktoré boli vtedy už dostatočne známe. A v roku 1918 dostal Nobelovu cenu. Planck zaviedol diskrétnu štruktúru energetického spektra ako z núdze cnosť. Túto myšlienku však bral len ako keby, ako užitočný trik, a v skutočné kvantovanie energie ani on, ani nikto iný neveril.
Ako prvý prisúdil diskrétnym energiám skutočnú existenciu v roku 1905 najznámejší patentový úradník všetkých čias – Albert Einstein (1879 – 1955). Všimol si, že Planckova hypotéza sa dá interpretovať aj inak. Svetlo sa správa, akoby sa nešírilo spojito, ale v balíčkoch s energiou úmernou frekvencii a Planckovej konštante. Slabo zahriate vlákno jednoducho nedokáže vytvoriť balíčky s vysokou energiou a nedochádza k sporom. A. Einstein odvodil Planckov výsledok, jeho úvahy sa však netýkali vlákna žiarovky, ale samotného svetla. A nerobil ich ako keby, ale naozaj. Popri tom si všimol, že šírenie svetla v kvantách, ktorých energia je úmerná frekvencii, jednoducho a priamočiaro vysvetľuje zdanlivo nesúvisiaci jav. Nemecký fyzik Heinrich Hertz (1857 – 1894) v roku 1887 pozoroval, že UV žiarenie pomáha vzniku iskier medzi nabitými vodičmi. Neskôr vedci, najmä pričinením ruského fyzika Alexandera Stoletova (1839 – 1896) a nemeckého fyzika Philippa Lenarda (1862 – 1947), mimochodom, bratislavského rodáka, zistili, že dopadajúce UV žiarenie dokáže z kovov uvoľňovať elektróny. Tieto elektróny pomáhajú viesť elektrický prúd, a tak dostalo vyrážanie elektrónov z kovu svetlom meno fotoelektrický efekt. Množstvo vyrazených elektrónov rastie s intenzitou žiarenia, ale ich energia závisí iba od jeho frekvencie. A. Einstein si uvedomil, že presne takéto správanie by sa dalo očakávať, keby jeden elektrón vedel interagovať iba s jedným balíčkom energie dopadajúceho žiarenia. Zvýšením intenzity svetla zväčšíme počet balíčkov, a teda aj počet uvoľnených elektrónov, ale ich energia zostane rovnaká. Zvýšením frekvencie zvýšime energiu, ktorú nesie jeden balíček, a teda aj energiu, ktorú si elektrón po uvoľnení odnesie. A. Einstein tým predpovedal presnú závislosť medzi energiou uvoľneného fotónu a frekvenciou dopadajúceho žiarenia, ktorá bola overená v roku 1914. Myšlienka, že svetlo má vlastnosti prúdu častíc, bola oveľa prevratnejšia, ako by sa v súčasnosti mohlo zdať. Dôkazom je, že A. Einsteinovi priniesla Nobelovu cenu, a to najmä preto, lebo minimálne sto rokov boli ľudia presvedčení, že svetlo sa správa ako vlnenie.
Atómy by nemali existovať
Do roku 1911 sa všetky kvantové úvahy týkali svetla. No po tom, ako Ernest Rutherford (1871 – 1937) so spolupracovníkmi objavili atómové jadro (pozri Quark 2/2019), bolo nutné tieto myšlienky rozšíriť na všetku hmotu. Štruktúra atómu ako akejsi miniatúrnej slnečnej sústavy, v ktorej elektróny obiehajú okolo jadra pod pôsobením elektrickej sily podľa zákonov klasickej fyziky, sa objavila dokonca ešte pred Rutherfordovým objavom. Už vtedy však bolo jasné, že také niečo nemôže fungovať. Elektrické náboje pri zrýchľovaní vyžarujú elektromagnetické žiarenie, ktoré odnáša časť ich energie. Je to dôsledok zákonov elektrodynamiky a fungujú tak antény a vysielače. Telesá zrýchľujú aj pri pohybe po kružnici, pretože sa mení smer ich rýchlosti, a elektróny obiehajúce okolo jadra by za nepatrný zlomok sekundy všetku svoju energiu vyžiarili a spadli do neho. Keby sa atómy riadili klasickou fyzikou, boli by nestabilné. Tak, ako ich objavil E. Rutherford, nemali vo svete riadenom klasickou fyzikou existovať, podobne ako Planckova žiarovka nemala svieť.
Častice sú vlny

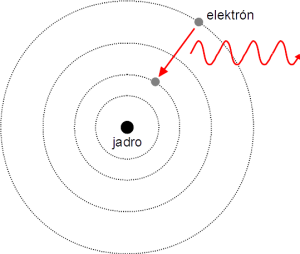
Prvý významný krok k vysvetleniu tohto sporu spravil v roku 1913 dánsky fyzik Niels Bohr (1885 – 1962), ktorý bol v tom čase Rutherfordov študent. Podľa N. Bohra mohli elektróny v atóme obiehať okolo jadra iba po istých, veľmi presne určených dráhach. Pri pohybe na nich nestrácajú energiu a pri prechode medzi dráhami elektrón vyžiari fotón s frekvenciou danou rozdielom energií v týchto dráhach. Tak by vznikali čiary v spektrách prvkov, o ktorých sme písali v úvode, pretože je možných len niekoľko konkrétnych prechodov. Keď sa N. Bohr usiloval nájsť dráhy, ktoré by viedli k zákonu objavenému Johannom Jakobom Balmerom (1825 – 1898), všimol si, že takéto dráhy by zodpovedali veľmi zaujímavej podmienke: moment hybnosti elektrónu nemôže byť ľubovoľný, ale môže byť iba celočíselným násobkom Planckovej konštanty. Priamočiaro tým prepojil črtajúce sa kvantové vlastnosti hmoty s kvantovými vlastnosťami svetla. Takýto model atómu veľmi dobre predpovedal frekvencie spektrálnych čiar pre vodík, no pre zložitejšie prvky to už tak dobre nefungovalo. Bohrov model tiež nevysvetľoval, prečo sa elektróny správajú práve takto. Keď ani zovšeobecnenia modelu neviedli k správnym výsledkom, bolo treba skúsiť niečo iné. Kľúčový sa ukázal nápad francúzskeho fyzika Louisa de Broglieho (1892 – 1987). Ak sa svetlo môže správať ako vlna a aj ako častica, prečo by podobné vlastnosti nemohli mať aj elektróny, protóny a ďalšie častice hmoty? To bol definitívny krok od klasickej fyziky ku kvantovej. V Bohrových myšlienkach sa elektróny ešte riadili klasickou fyzikou, doplnenou o nové obmedzenia. V roku 1924 de Broglie svoju teóriu rozpracoval a ako jeden z dôsledkov dostal Bohrov model. To, že elektróny sa v istých situáciách, napríklad pri odraze od kryštálu, správajú naozaj ako vlny, dokázali v roku 1926 americkí fyzici Clinton Davisson (1881 – 1958) a Lester Germer (1896 – 1971). Klasická fyzika je na kolenách, elektromagnetické vlny sa správajú aj ako častice a častice sa správajú aj ako vlny. Je jasné, že v mikrosvete fungujú veci úplne inak, ako by sme čakali. Ešte potrebujeme nájsť fyzikálne zákony pre nové vlno-častice, ale to sa podarilo prekvapivo rýchlo.
Myšlienky častíc ako vĺn sa chytil rakúsky fyzik Erwin Schrödinger (1887 – 1961). Jeho cieľom bolo vrátiť spojitosť do mikrosveta a v rokoch 1925 a 1926 sa mu podarilo sformulovať rovnicu pre spojité vlny popisujúce častice. Diskrétne energie dostal až ako jej riešenia. Doteraz nazývame túto rovnicu Schrödingerovou a je základným kameňom celej kvantovej teórie. Interpretácia jej riešení ako niečoho skutočne materiálneho však mala veľa problémov a ešte v roku 1926 nemecký fyzik Max Born (1882 – 1970) usúdil, že je najrozumnejšie interpretovať ich pravdepodobnostne. Pravdepodobnosti boli záverečný, skutočne kvantový prvok. Vlnové funkcie, ktoré spĺňajú Schrödingerovu rovnicu, nehovoria o konkrétnej polohe častíc, ale iba o pravdepodobnosti častice pozorovať. Neexistujú konkrétne dráhy, po ktorých elektróny obiehajú okolo jadra, ale len miesta, kde sa nachádzajú s väčšou pravdepodobnosťou.
Kvantová mechanika
V roku 1926 zostávalo ešte veľa práce a dotiahnuť porozumenie mikrosvetu do súčasnej podoby, ktorá tiež nie je bez medzier, vyžadovalo výskum niekoľkých generácií fyzikov. No kvantové zákony a predstava o ich fungovaní boli na svete. Kvantová mechanika je fundamentálna teória sveta, v ktorom žijeme, a je základom pre nespočetné množstvo technických aplikácií. Predstavuje veľmi zvláštne pravidlá pre najmenšie častice hmoty s ešte zvláštnejšími dôsledkami. Pre veľké veci, ktoré sa skladajú z veľmi veľa častíc, takmer všetky tieto zvláštnosti vymiznú a telesá sa dajú popísať newtonovskou fyzikou. Ale kvantová mechanika stále platí.
Mgr. Juraj Tekel, PhD.
Katedra teoretickej fyziky a didaktiky fyziky
FMFI UK v Bratislave
Foto Fotky&Foto, Pixabay a autor