 Cieľom vedy je zabaliť do čo najmenšieho počtu slov čo najviac vedomostí. Keďže viac-menej všetkému rozumieme na základe existencie atómov, vedomosť o ich jestvovaní je pre nás veľmi dôležitá. Odkiaľ ju máme?
Cieľom vedy je zabaliť do čo najmenšieho počtu slov čo najviac vedomostí. Keďže viac-menej všetkému rozumieme na základe existencie atómov, vedomosť o ich jestvovaní je pre nás veľmi dôležitá. Odkiaľ ju máme?
Atómy sú ako pixely na digitálnom obrázku. Z diaľky obrázok vyzerá súvislý, ale keď si ho priblížime, vidíme, že sa skladá z malých štvorčekov. Podobne sa náš svet skladá z atómov. Najväčšie veci, ktoré dokážeme ešte ako-tak vnímať, majú asi 10 km, najmenšie 0,1 mm. To je pomer 108. Atómy sú až nepredstaviteľne malé. Veľkosť atómov a molekúl je približne 10-10 m, takže veľkosť atómu stonásobne presahuje naše schopnosti vnímania vzdialeností. Principiálne sa atóm nedá vidieť. Fotón, teda svetlo, sa odrazí od predmetu do nášho oka a podľa toho vieme, čo tam je. Veľkosť fotónov viditeľného svetla je približne 10-7 m, čo je asi 1 000-krát viac ako veľkosť atómov. Pohyb viditeľného svetla sa na takom malom objekte nijako nezmení a jednotlivé atómy pre nás zostávajú priamo neviditeľné. Odhaliť existenciu atómov bolo ťažké z jednoduchého dôvodu – atómy sú maličké a pre technológie do roku 1910 úplne neviditeľné. Ich existenciu bolo treba uhádnuť z veľkého množstva nepriamych dôkazov a náznakov. Príbeh tohto objavu je veľmi zaujímavý a debata o existencii atómov bola jedna z najzapálenejších v histórii vedy.
Už antickí Gréci…
Idea neviditeľnej štruktúry hmoty sa v starovekých filozofiách objavila viackrát. Okrem nám dobre známej gréckej aj v indickej. Tieto nápady sú v modernom ponímaní vedy výstrel od pása, aj keď Grékov k nemu viedol filozofický dôvod, ktorý má čosi do seba. Názov atóm pochádza z gréckeho slova atomos, nedeliteľný. V 5. storočí pred n. l. prišli Leukippos a Démokritos s myšlienkou, že sa všetko skladá z atómov, ktoré sú nedeliteľné a nezničiteľné. Podľa ich teórie sa atómy vedia spájať do komplikovanejších útvarov, a tak vznikajú rôzne makroskopické látky. Vychádzali z toho, že na najhlbšej úrovni je príroda jednoduchá. Z niekoľkých druhov atómov by sme vedeli dostať veľa rôznych látok tak, ako z legových kociek vieme poskladať veľa rôznych skladačiek. Ukázalo sa, že mali, tak trochu náhodou, pravdu. V 4. storočí pred n. l. ovládol grécku filozofiu Aristoteles (384 – 322 pred n. l.). Hlásal, že všetky myšlienky musia byť založené na empirickom základe a pozorovaní. Síce to bol na dlhý čas koniec akýmkoľvek atómovým hypotézam, no tým dal základ tomu, čo teraz nazývame prírodné vedy.
Chémia na scéne
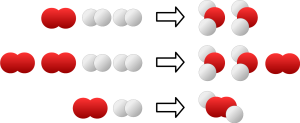 Na ďalší pokrok si ľudstvo muselo počkať viac ako dvetisíc rokov. V moderných časoch si ako prví všimli existenciu atómov chemici. Chemická reakcia je totiž veľa rovnakých procesov priamo na atomárnej úrovni. Atómy prezradilo, že chemické recepty sú úplne iné ako tie kuchynské. Ako príklad kuchynského receptu zoberme Gin&Tonic Naň potrebujeme ľad, 0,5 dl ginu, 1 dl toniku a rez limetky. Podľa chemického receptu na jeden deciliter vody potrebujeme 88,81 g kyslíka a 11,19 g vodíka. Ak v prvom recepte pridáme gin, dostaneme trochu silnejší nápoj, ale ešte vždy nápoj. Ak však v recepte na výrobu vody pridáme viac kyslíka, nedostaneme kyslíkovejšiu vodu, ale naďalej to bude deci vody a zvyšný kyslík. Na základe množstva rôznych chemických výsledkov v roku 1808 anglický chemik John Dalton (1766 – 1844) sformuloval tri zákony chemických reakcií: zákon zachovania hmotnosti, zákon stálych hmotnostných pomerov, zákon množných hmotnostných pomerov. Prvý pôsobí ako samozrejmosť, ale v čase jeho objavu to tak nebolo. Druhý zákon hovorí to, čo sme povedali pri popise receptov – chemikálie sa pri reakciách nemôžu miešať ľubovoľne a ak pridáme jednu, musíme v patričnom pomere pridať aj ostatné.
Na ďalší pokrok si ľudstvo muselo počkať viac ako dvetisíc rokov. V moderných časoch si ako prví všimli existenciu atómov chemici. Chemická reakcia je totiž veľa rovnakých procesov priamo na atomárnej úrovni. Atómy prezradilo, že chemické recepty sú úplne iné ako tie kuchynské. Ako príklad kuchynského receptu zoberme Gin&Tonic Naň potrebujeme ľad, 0,5 dl ginu, 1 dl toniku a rez limetky. Podľa chemického receptu na jeden deciliter vody potrebujeme 88,81 g kyslíka a 11,19 g vodíka. Ak v prvom recepte pridáme gin, dostaneme trochu silnejší nápoj, ale ešte vždy nápoj. Ak však v recepte na výrobu vody pridáme viac kyslíka, nedostaneme kyslíkovejšiu vodu, ale naďalej to bude deci vody a zvyšný kyslík. Na základe množstva rôznych chemických výsledkov v roku 1808 anglický chemik John Dalton (1766 – 1844) sformuloval tri zákony chemických reakcií: zákon zachovania hmotnosti, zákon stálych hmotnostných pomerov, zákon množných hmotnostných pomerov. Prvý pôsobí ako samozrejmosť, ale v čase jeho objavu to tak nebolo. Druhý zákon hovorí to, čo sme povedali pri popise receptov – chemikálie sa pri reakciách nemôžu miešať ľubovoľne a ak pridáme jednu, musíme v patričnom pomere pridať aj ostatné.
Rovnaké správanie
 Podľa tretieho zákona je v chemických reakciách ešte ďalšia štruktúra. Ak dva prvky vedia reagovať viac ako jedným spôsobom, tieto reakcie sú v špeciálnom vzťahu. Napríklad okrem vody vie 94,07 g kyslíka a 5,93 g vodíka vytvoriť 100 g peroxidu vodíka. Ak vydelíme tieto dve čísla, dostaneme dvakrát väčšie číslo ako v prípade vzniku vody. Pre iné prvky to nemusí byť dva, ale vždy takto dostaneme rozumný zlomok. K týmto zákonom francúzsky chemik Joseph Gay-Lussac (1778 – 1850) pridal pozorovanie, že aj objemy plynov v chemických reakciách majú striktnú štruktúru. Tieto zákony sa dajú vysvetliť existenciou atómov. Atómy rovnakého prvku sa správajú vždy rovnako, v chemických reakciách sa nemenia, len sa podľa istých pravidiel rôzne viažu do molekúl. Určenie relatívnych atómových hmotností je komplikovaná hádanka, v ktorej treba robiť predpoklady o atómovom obsahu jednotlivých zlúčenín a testovať konzistentnosť všetkých známych reakcií. Tak sa dajú určiť relatívne atómové hmotnosti prvkov a táto snaha viedla k Mendelejevovej periodickej tabuľke (1869). Atómová hypotéza bola silná vo vysvetlení známych procesov, ale nepriniesla žiadne nové predpovede a zostala na úrovni užitočného pracovného nástroja. Existencia atómov ako reálnych objektov nebola univerzálne prijatá.
Podľa tretieho zákona je v chemických reakciách ešte ďalšia štruktúra. Ak dva prvky vedia reagovať viac ako jedným spôsobom, tieto reakcie sú v špeciálnom vzťahu. Napríklad okrem vody vie 94,07 g kyslíka a 5,93 g vodíka vytvoriť 100 g peroxidu vodíka. Ak vydelíme tieto dve čísla, dostaneme dvakrát väčšie číslo ako v prípade vzniku vody. Pre iné prvky to nemusí byť dva, ale vždy takto dostaneme rozumný zlomok. K týmto zákonom francúzsky chemik Joseph Gay-Lussac (1778 – 1850) pridal pozorovanie, že aj objemy plynov v chemických reakciách majú striktnú štruktúru. Tieto zákony sa dajú vysvetliť existenciou atómov. Atómy rovnakého prvku sa správajú vždy rovnako, v chemických reakciách sa nemenia, len sa podľa istých pravidiel rôzne viažu do molekúl. Určenie relatívnych atómových hmotností je komplikovaná hádanka, v ktorej treba robiť predpoklady o atómovom obsahu jednotlivých zlúčenín a testovať konzistentnosť všetkých známych reakcií. Tak sa dajú určiť relatívne atómové hmotnosti prvkov a táto snaha viedla k Mendelejevovej periodickej tabuľke (1869). Atómová hypotéza bola silná vo vysvetlení známych procesov, ale nepriniesla žiadne nové predpovede a zostala na úrovni užitočného pracovného nástroja. Existencia atómov ako reálnych objektov nebola univerzálne prijatá.
Pomáhajúca viskozita
Aj vo fyzike sú makroskopické procesy, ktorými atómy nepriamo prezrádzajú svoju existenciu. Najvýraznejšie sú pri plynoch a mnohé vlastnosti plynov sa dajú jednoducho vysvetliť predpokladom, že sa skladajú z maličkých častíc. Napríklad tlak vzniká pri odrazoch častíc od stien nádoby, teplota súvisí s kinetickou energiou ich pohybu. V roku 1738 si to všimol švajčiarsky matematik Daniel Bernoulli (1700 – 1782), ale do polovice 19. storočia zostala táto myšlienka nepovšimnutá. Za znovuobjavením tejto myšlienky sú dôkazy proti alternatívnym vysvetleniam termodynamických dejov a čoraz väčšia popularita atómov medzi chemikmi. Záujem o atómovú hypotézu rozdúchali najmä Angličan James Joule (1818 – 1889) a Nemec Rudolf Clausius (1822 – 1888). Okrem vzťahu medzi tlakom, teplotou a objemom popísali mnohé iné termodynamické a mechanické vlastnosti, napríklad vnútorné trenie v plyne, viskozitu. Zo známej viskozity vzduchu sa prvý raz podarilo odhadnúť veľkosť molekúl. Viskozitu spôsobujú zrážky medzi molekulami a frekvencia zrážok súvisí s tým, aké sú molekuly veľké. Takto roku 1865 rakúsky fyzik a chemik Johann Loschmidt (1821 – 1895) odhadol veľkosť molekúl vo vzduchu na 10-9 m.
V druhej polovici 19. storočia sa množstvo vedcov, na čele so škótskym fyzikom Jamesom Maxwellom (1831 – 1879) a rakúskym fyzikom Ludwigom Boltzmannom (1844 – 1906), podujalo postupne odvodiť makroskopické vlastnosti látok z hypotézy, že sa skladajú z atómov. Túto snahu nazývame štatistická fyzika. Je založená na tom, že polohy a rýchlosti všetkých molekúl nemôžeme poznať, lebo ich je veľmi veľa. To však ani nepotrebujeme, lebo stav látky je určený iba niekoľkými veličinami. Charakteristiky jednotlivých molekúl môžeme považovať za náhodné a na určenie makroskopických vlastností látok nám stačí poznať niektoré priemerné hodnoty. Štatistická fyzika však nebola po chuti odporcom atómovej hypotézy, ktorých reprezentovali najmä nemecký chemik Wilhelm Ostwald (1853 – 1932) a rakúsky fyzik Ernst Mach (1838 – 1916). Keďže sa už vedelo, že atómy sú na pozorovanie primalé, hlavný protiargument spočíval vo vratnosti mechanických dejov a nevratnosti dejov s plynmi. Tento argument predniesol ako prvý práve Loschmidt, súvisiaci argument dokázal francúzsky matematik Henri Poincaré (1854 – 1912). Ich argumenty sú založené na tom, že dynamika mechanických systémov spĺňa isté pravidlá. Napríklad, že k ľubovoľnému procesu je možný aj proces bežiaci opačne, alebo, že po čase sa každý systém svojou dynamikou dostane do podobného stavu, z ktorého začínal. Plyn sa však v ľubovoľnej nádobe veľmi rýchlo rozptýli bez ohľadu na to, ako je v nej na začiatku usporiadaný. V takomto stave zotrvá a nejaví známky zmeny. Plyny majú tendenciu zabúdať na svoju počiatočnú konfiguráciu a smerovať k ustálenému stavu bez ohľadu na to, v akom stave začínali. To všetko je v rozpore s mechanickou hypotézou. Samotná idea štatistickej fyziky – nie všetko je exaktné a na isté veci sa treba pozerať v termínoch štatistiky – bola mnohým proti srsti. Je to totiž proti ideám exaktnej fyziky. V neposlednom rade z atómovej hypotézy dovtedy nič nevyplývalo, existencia atómov veci iba vysvetľovala spätne, ale nič nepredpovedala.
Brownov pohyb
 Kľúčovú úlohu v debate o existencii atómov zohral Brownov pohyb. Ide o pohyb veľmi malých častíc na hladine kvapaliny pozorovaný pod mikroskopom, pri ktorom častice rýchlo a chaoticky poskakujú. Prvý raz to boli častice uhoľného prachu, ktoré pozoroval holandský lekár Jan Ingenhousz (1730 – 1799) koncom 18. storočia, v roku 1827 pozorovania zrniečok peľu anglickým botanikom Robert Brownom (1773 – 1858). Albert Einstein (1879 – 1955), v tom čase mladý vedec, ktorého zaujímali tie najvýznamnejšie otázky, videl začiatkom 20. storočia v Brownovom pohybe príležitosť nájsť experimentálne overiteľnú predpoveď atómovej hypotézy. Idea je podobná ako pri tlaku plynu, ale pre malú a ľahkú časticu nebude efekt nárazov rovnovážny. V niektorých momentoch bude na časticu narážať viac molekúl ako inokedy, bude dostávať rôzne veľké kopance v rôznych smeroch. Jej pohyb bude náhodný a neusporiadaný. Einstein z predpokladov štatistickej fyziky a atómovej hypotézy odvodil v roku 1905 presný vzťah pre priemernú veľkosť kroku, ktorý za daný čas malá častica spraví. Predpoveď existencie atómov bola na svete. Píše: Ak bude tento pohyb pozorovaný, bude možné presné určenie atomárnych veľkostí. Ak sa však predpovede tohto pohybu ukážu nesprávne, znamenalo by to silný argument proti molekulárno-kinetickej teórii tepla. Po publikácii Einsteinovho článku sa podarilo overiť túto predpoveď niekoľkým experimentátorov. Prvý úspešný bol francúzsky fyzik Jean Perrin (1870 – 1942). V roku 1908 precízne nameral rozdelenie veľkosti krokov v Brownovom pohybe, vo výbornej zhode s Einsteinovou predpoveďou. To bol chýbajúci a definitívny argument v prospech atómovej hypotézy, z ktorej sa tak stala atómová teória.
Kľúčovú úlohu v debate o existencii atómov zohral Brownov pohyb. Ide o pohyb veľmi malých častíc na hladine kvapaliny pozorovaný pod mikroskopom, pri ktorom častice rýchlo a chaoticky poskakujú. Prvý raz to boli častice uhoľného prachu, ktoré pozoroval holandský lekár Jan Ingenhousz (1730 – 1799) koncom 18. storočia, v roku 1827 pozorovania zrniečok peľu anglickým botanikom Robert Brownom (1773 – 1858). Albert Einstein (1879 – 1955), v tom čase mladý vedec, ktorého zaujímali tie najvýznamnejšie otázky, videl začiatkom 20. storočia v Brownovom pohybe príležitosť nájsť experimentálne overiteľnú predpoveď atómovej hypotézy. Idea je podobná ako pri tlaku plynu, ale pre malú a ľahkú časticu nebude efekt nárazov rovnovážny. V niektorých momentoch bude na časticu narážať viac molekúl ako inokedy, bude dostávať rôzne veľké kopance v rôznych smeroch. Jej pohyb bude náhodný a neusporiadaný. Einstein z predpokladov štatistickej fyziky a atómovej hypotézy odvodil v roku 1905 presný vzťah pre priemernú veľkosť kroku, ktorý za daný čas malá častica spraví. Predpoveď existencie atómov bola na svete. Píše: Ak bude tento pohyb pozorovaný, bude možné presné určenie atomárnych veľkostí. Ak sa však predpovede tohto pohybu ukážu nesprávne, znamenalo by to silný argument proti molekulárno-kinetickej teórii tepla. Po publikácii Einsteinovho článku sa podarilo overiť túto predpoveď niekoľkým experimentátorov. Prvý úspešný bol francúzsky fyzik Jean Perrin (1870 – 1942). V roku 1908 precízne nameral rozdelenie veľkosti krokov v Brownovom pohybe, vo výbornej zhode s Einsteinovou predpoveďou. To bol chýbajúci a definitívny argument v prospech atómovej hypotézy, z ktorej sa tak stala atómová teória.
Ak chcete mať prístup aj k exkluzívnemu obsahu pre predplatiteľov alebo si objednať tlačenú verziu časopisu Quark, prihláste sa alebo zaregistrujte.
Mgr. Juraj Tekel, PhD.
Katedra teoretickej fyziky
Fakulty matematiky, fyziky a informatiky
Univerzity Komenského v Bratislave
Foto Pixabay, archív autora







